Premium
KI-professor om försök med Crispr och mRNA: Dramatisk effekt
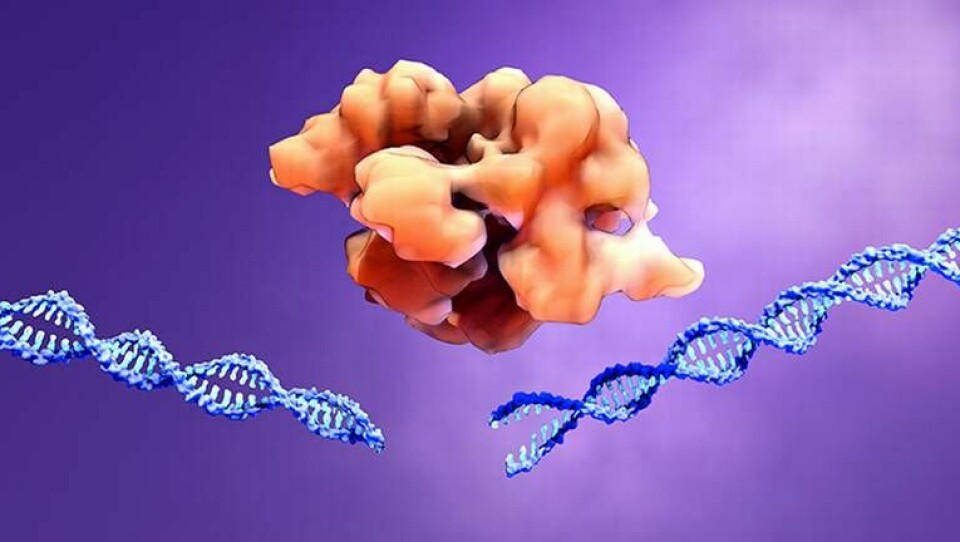
Gensaxen Crispr i kombination med mRNA-teknik har gett lovande tidiga resultat vid behandling av patienter med Skelleftesjukan. – Det är en banbrytande studie, säger KI-professor Kenneth Chien.
Annons