Populärteknik
Alkemisten från Nya Zeeland
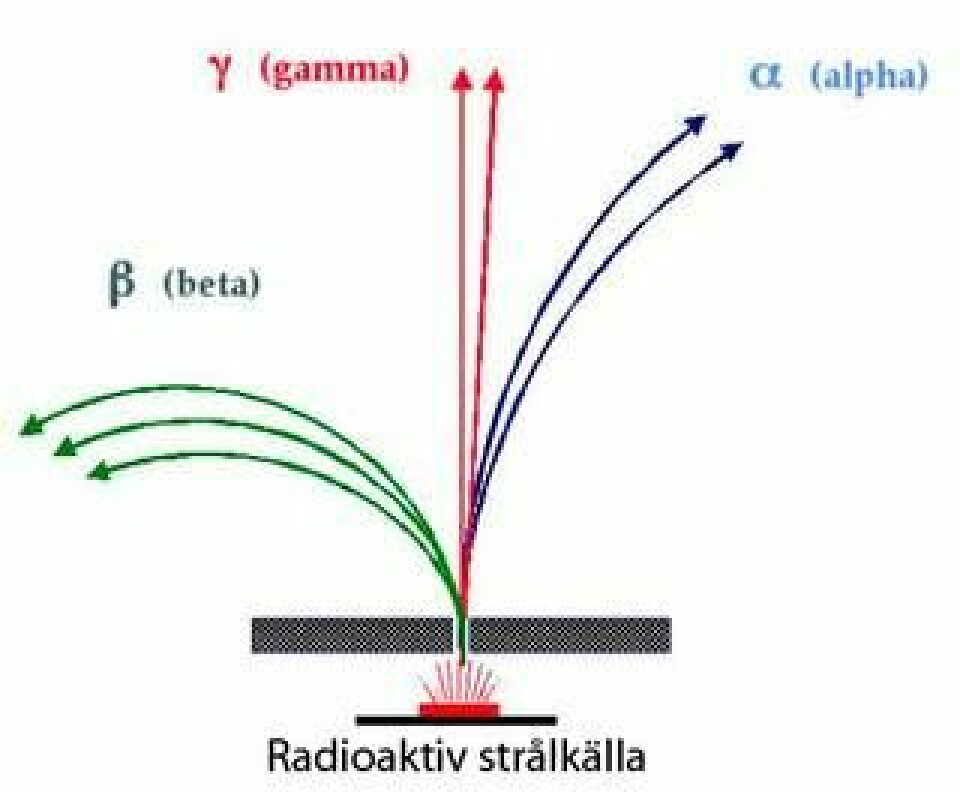
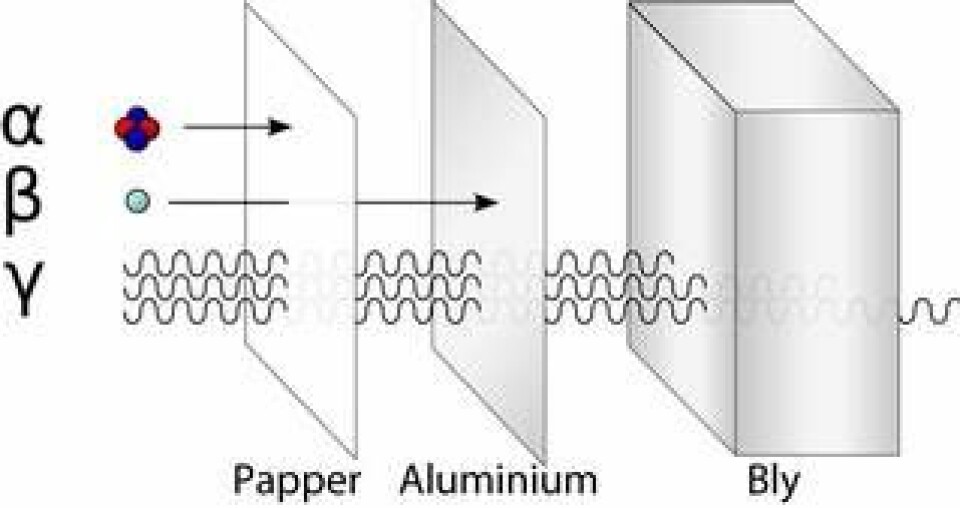
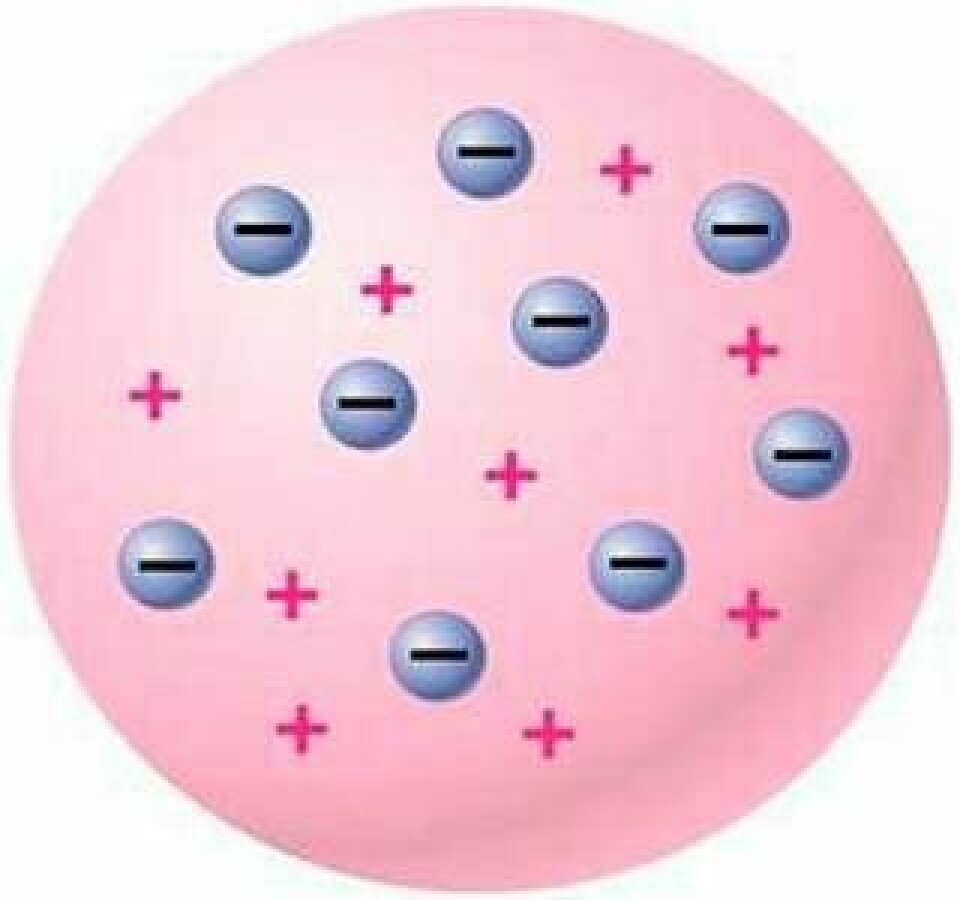
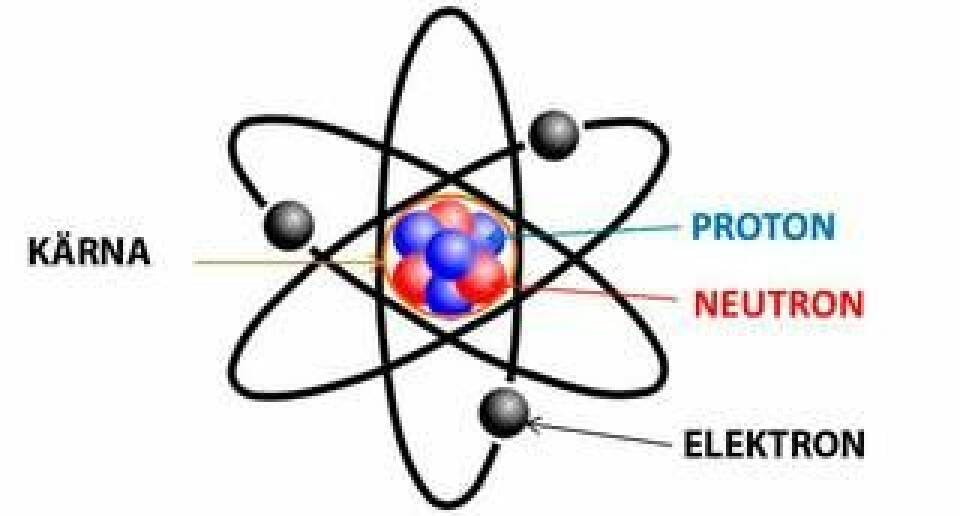
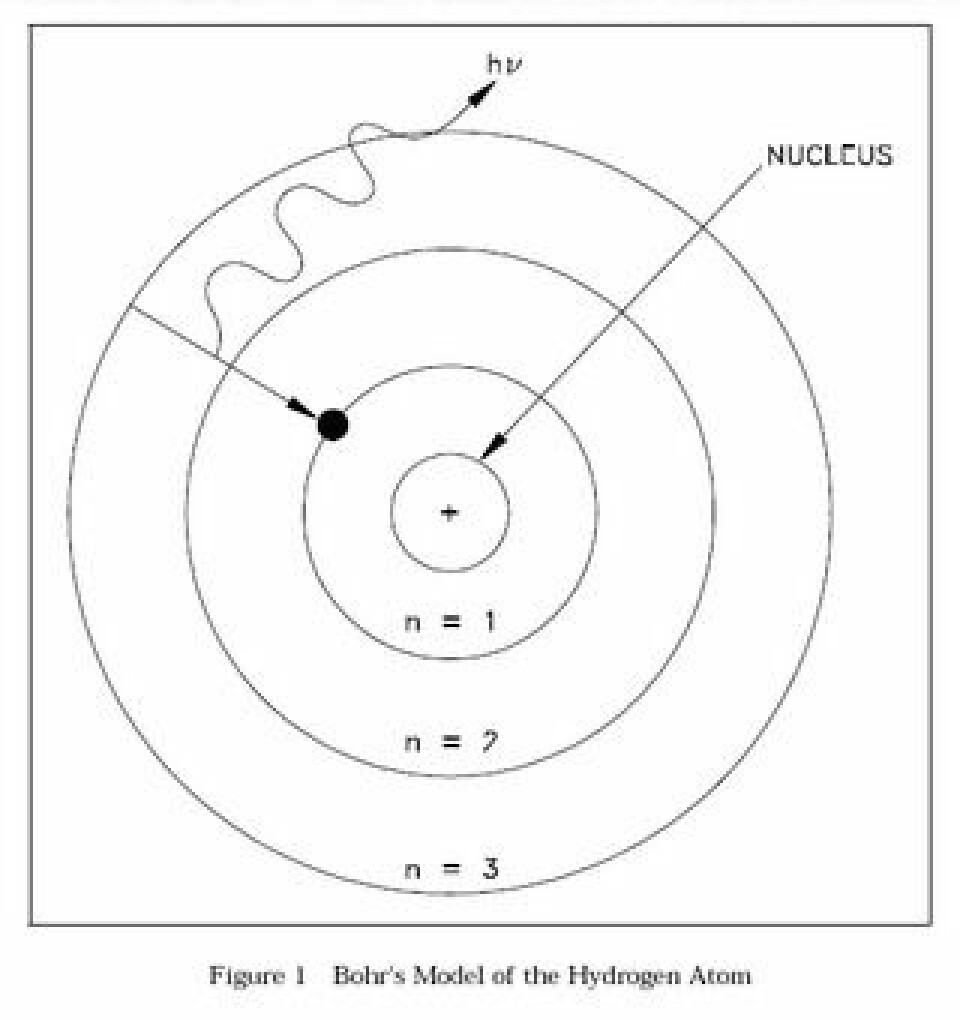
Ernest Rutherford insåg att radioaktivitet i grund och botten är kärnreaktioner där grundämnen transmuteras till andra. Detta ledde till att han för hundra år sedan upptäckte atomernas inre struktur och kunde genomföra världens första atomklyvning.
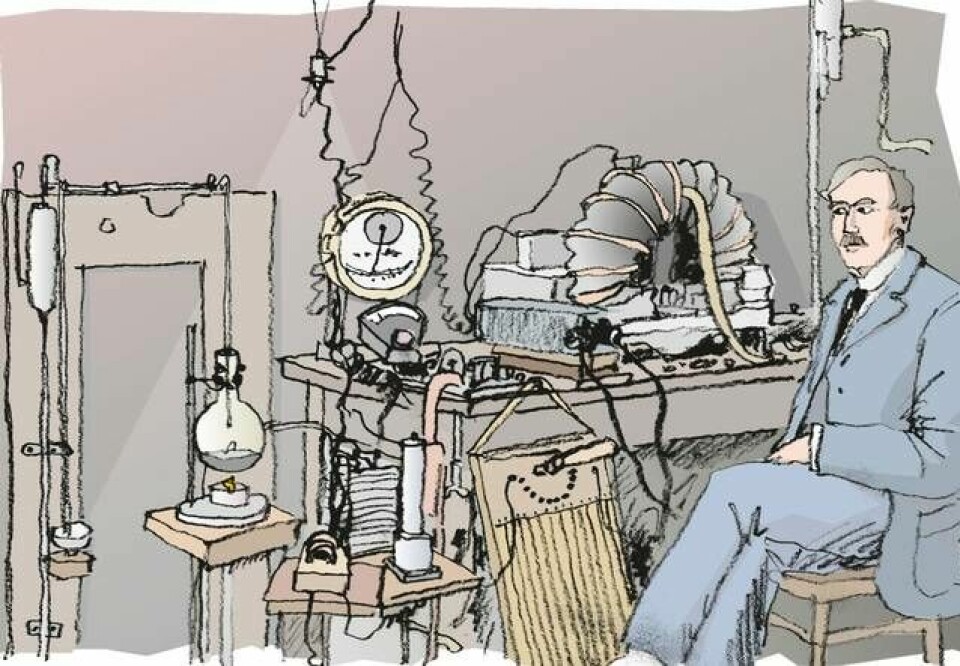
Den stora världsutställningen i Hyde Park i London 1851, den första i sitt slag, blev en stor succé. Inte minst ekonomiskt. Det beslutades av en del av överskottet skulle gå till stipendier till lovande forskare från de brittiska kolonierna så att de skulle kunna studera vidare vid valfri institution inom imperiet. År 1895 utsågs en ung bondson vid namn Ernest Rutherford som Nya Zeelands stipendiat. Han begav sig omedelbart till Cambridge och Cavendishlaboratoriet, Englands ledande fysikaliska forskningsinstitution.
Rutherford hade på Nya Zeeland börjat forska om Hertzvågor, trådlös överföring, och hade uppfunnit en ny typ av detektor. I Cambridge fortsatte han sitt arbete, och höll under en kort tid världsrekordet i trådlös överföring – ett par hundra meter.