Premium
Gensaxen kan förändra livets kod: ”Det här är en teknik med två sidor”
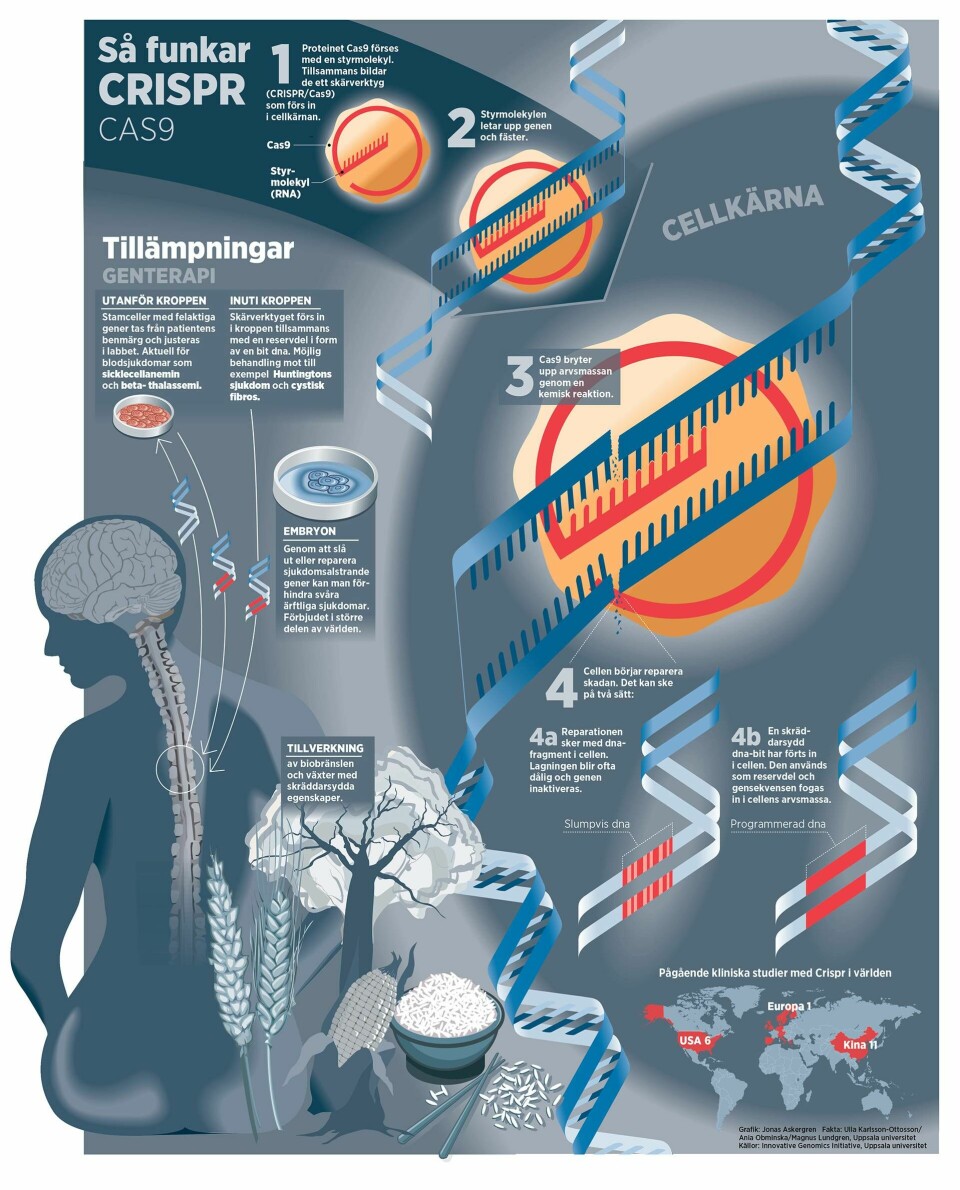
Med Crispr-tekniken kan vi förändra människans utveckling. Kommer vi att stanna vid att behandla och förebygga sjukdomar, eller är lockelsen att använda gensaxen till förbättringar för stor? Ny Teknik har intervjuat forskaren Jennifer Doudna.
Annons